IV - Como ocorrem as reações químicas?
4.1.2 Ruptura heterolítica ou heterólise
Na cisão heterolítica, a quebra da ligação é feita de modo desigual, e o par eletrônico fica apenas com um dos átomos ligantes.
As rupturas heterolíticas frequentemente ocorrem em ligações polarizadas (diferença de eletronegatividade), em presença de solventes polares, à custa de pouca energia.
Ordem decrescente de eletronegatividade de elementos de tabela periódica: F, O, N, Cl, Br, I, S, C, P, H.
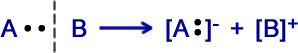
Na ruptura heterolítica, uma das espécies ganha elétrons e a outra perde ocorrendo, portanto, formação de íons.
1º Exemplo - Molécula de metano (CH4)
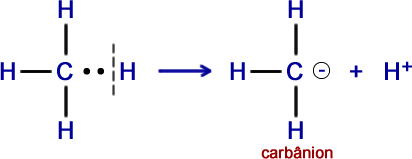
Observe que o carbono fica com o par eletrônico e colabora para a formação de um carbânion e um íon H+ (próton).
2º Exemplo - Molécula de brometo de metila (CH3Br)
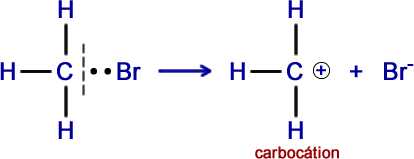
Rompendo-se heteroliticamente a ligação entre carbono e bromo, teremos um carbocátion e um íon brometo (ânion).
O elemento bromo é mais eletronegativo e leva consigo o par eletrônico.






